
Le guide de la médecine et de la santé
en Afrique francophone
Suivez-nous :
 Identifiez-vous | Inscription
Identifiez-vous | Inscription

Suivez-nous :
 Identifiez-vous | Inscription
Identifiez-vous | Inscription

Les laboratoires Pierre Fabre ont organisé, le 27 octobre 2022, les Rencontres Africaines de Gynécologie avec 8 professeurs de gynécologie et de chirurgie d'Afrique francophone et 2 thématiques :
Nous vous proposons de voir ou revoir la communication portant sur les vulvo-vaginites :
Professeur Jack Bang Ntamack
Gynécologue. CHU Mère-enfant - Fondation Jeanne Ebori - Libreville Gabon.


Cyteal® est indiqué chez les prématurés, les nouveau-nés, les nourrissons, les enfants, les adolescents et les adultes pour le nettoyage des affections de la peau et des muqueuses primitivement bactériennes ou susceptibles de se surinfecter.
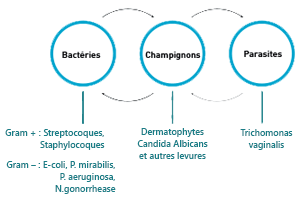
Association de 3 actifs synergiques garantissant la décontamination bactérienne, fongique et trichomonacide, de la peau et des muqueuses
Le pH de Cytéal est de 5.
Respect de la flore saprophyte de la peau et de l’écosystème vaginal




Cyteal_Med_landing page_17.09.24_V1
Cytéal®, solution moussante.
Pour 100 ml de solution moussante :
Pour la liste complète des excipients, voir rubrique 6.1.
Solution moussante.
Solution visqueuse jaune pâle. Mousse quand secouée.
CYTEAL est indiqué chez les prématurés, les nouveau-nés, les nourrissons, les enfants, les adolescents et les adultes pour le nettoyage des affections de la peau et des muqueuses primitivement bactériennes ou susceptibles de se surinfecter.
Remarque : Les agents antiseptiques ne sont pas stérilisants. Ils réduisent temporairement le nombre de micro-organismes.
Une à deux applications par jour pendant 7 à 10 jours.
Ce produit s'utilise comme un savon liquide en usage externe : pur, ou dilué au 1/10 avec de l'eau.
Les zones traitées doivent toujours être rincées abondamment avec de l'eau après utilisation.
VOIE EXTERNE. NE PAS INJECTER. NE PAS AVALER.
Hypersensibilité aux substances actives ou à l'un des excipients mentionnés à la rubrique 6.1
Cette préparation ne doit pas être utilisée :
Ce produit ne doit pas être mis en contact avec l'œil, le cerveau et les méninges, ni pénétrer dans le conduit auditif en cas de perforation tympanique.
En l'absence de données sur la résorption transcutanée, le risque d'effets systémiques ne peut être exclu. Ils sont favorisés par la répétition des applications et d'autant plus à redouter que l'antiseptique est utilisé sur une grande surface, sous pansement occlusif, sur une peau lésée (notamment brûlée), une muqueuse, une peau de prématuré ou de nourrisson (en raison du rapport surface/poids et de l'effet d'occlusion des couches au niveau du siège).
Des cas de dermatite de contact (dermatite allergique comprise) ont été rapportés sous hexamidine et deux excipients contenus dans la solution cutanée (voir section 4.8). En cas de symptômes graves, CYTEAL doit être interrompu et les patients doivent consulter un médecin avant toute nouvelle utilisation de CYTEAL.
Ce médicament peut provoquer une réaction allergique généralisée grave en raison de la présence de chlorhexidine pouvant survenir quelques minutes après l'application.
Comme avec toutes les substances détergentes, rincer soigneusement la zone traitée après utilisation.
CYTEAL ne doit pas entrer en contact avec les yeux. Des cas graves de lésions cornéennes persistantes, pouvant nécessiter une greffe de la cornée, ont été signalés à la suite d'une exposition oculaire accidentelle à des médicaments contenant de la chlorhexidine. Lors de l'application, il convient de faire preuve d'une extrême prudence pour s'assurer que CYTEAL se limite au site d'application prévu. Si CYTEAL entre en contact avec les yeux, rincer rapidement et soigneusement avec de l'eau. Il convient de demander conseil à un ophtalmologue.
Dès l’ouverture du conditionnement d’une préparation à visée antiseptique, une contamination microbienne est possible.
Si le flacon est supérieur à 250 ml : Le volume de ce flacon supérieur à 250 ml expose à un risque de contamination de la solution en cas d’utilisation prolongée après ouverture.
Aucune étude d’interaction n’a été réalisée.
Compte tenu des interférences possibles (antagonisme, inactivation...), l'emploi simultané ou successif d'autres produits à usage cutané est à éviter. En particulier ne pas utiliser en même temps que le savon ordinaire (voir rubrique 6.2).
Il n'existe pas de données sur l'utilisation de l'association du diisétionate d'hexamidine, du digluconate de chlorhexidine et du chlorocrésol chez la femme enceinte.
Les études effectuées chez l'animal avec CYTEAL n'ont pas mis en évidence d'effets délétères directs ou indirects sur la reproduction (voir rubrique 5.3).
Par mesure de précaution, il est préférable d'éviter l'utilisation de CYTEAL pendant la grossesse.
Aucun effet sur le nouveau-né/nourrisson allaité n'est attendu car l'excrétion dans le lait maternel des substances actives de CYTEAL est négligeable.
CYTEAL peut être utilisé pendant l'allaitement. Par mesure de précaution, il est recommandé de ne pas appliquer CYTEAL sur les seins pendant l'allaitement.
Les études effectuées chez l'animal n'ont pas mis en évidence d'effet de CYTEAL sur la fertilité dans les conditions normales d'utilisation (voir rubrique 5.3).
CYTEAL n’a aucun effet ou un effet négligeable sur l’aptitude à conduire des véhicules et à utiliser des machines.
Liste des effets indésirables sous forme de tableau :
les effets indésirables listés ci-dessous sont présentés par classe de système d'organes MedDRA et par fréquence. La fréquence des effets indésirables est définie comme suit : très fréquents (> 1/10), fréquents (> 1/100, < 1/10), peu fréquents (> 1/1 000, < 1/100), rares (> 1/10 000, < 1/1 000), très rares (< 1/10 000), fréquence indéterminée (ne peut être estimée à partir des données disponibles).
Au sein de chaque groupe de fréquence, les effets indésirables sont présentés par ordre décroissant de gravité.
| CLASSE DE SYSTÈME D'ORGANES (classification MedDRA) |
Fréquence indéterminée (ne peut être estimée à partir des données disponibles) |
|---|---|
| Affections du système immunitaire | Choc anaphylactique* Hypersensibilité*, Dermatite de contact** |
| Affections oculaires | Irritation oculaire*** Erosion de la cornée, lésion épithéliale/lésion cornéenne, déficience visuelle significative permanente **** |
| Affections de la peau et des tissus sous-cutanés | Réaction au site d'application***** |
* Risque d’allergie généralisée à la chlorhexidine, pouvant entraîner un choc anaphylactique qui pourrait mettre la vie en danger si aucun soin médical immédiat n'était pratiqué. Elle peut se manifester par des difficultés respiratoires, un gonflement du visage, une éruption cutanée grave. Si le patient fait face à une réaction allergique à la chlorhexidine, il doit immédiatement interrompre l’utilisation du produit et consulter un médecin.
** La dermatite de contact à l’hexamidine présente certaines particularités du phénomène d’Arthus, laissant supposer l’implication de mécanismes immunologiques humoraux.
L’hexamidine est susceptible d’entraîner une sensibilisation. Sa fréquence varie en fonction de la gravité de l'atteinte épidermique. Son aspect clinique diffère généralement d’un eczéma de contact classique : l'éruption cutanée est souvent infiltrée et composée de lésions hémisphériques papuleuses ou papulo-vésiculaires, isolées ou groupées. Plus nombreuses et coalescentes au site d’application de l’antiseptique, ces lésions se dispersent ensuite en éléments isolés. Leur régression est souvent lente.
Des cas de dermatite de contact probablement dus à la bétaïne de cocamidopropyle et au diéthanolamide d’acides gras de coco, deux excipients contenus dans la solution cutanée, ont été rapportés pendant la période post-commercialisation (voir section 4.4).
Eczéma de contact (risque d’allergie locale à la chlorhexidine, notamment en cas d’utilisation sur une peau lésée, des muqueuses ou des ulcères au niveau des jambes). L’eczéma de contact peut aggraver une lésion surinfectée.
*** Irritation oculaire : en cas d’exposition accidentelle
**** Des cas d'érosion cornéenne sévère et de déficience visuelle significative permanente dus à une exposition oculaire accidentelle ont été rapportés après la mise sur le marché, ce qui a entraîné la nécessité d'une transplantation cornéenne chez certains patients (voir rubrique 4.4).
***** Réactions d’intolérance locale : douleurs intenses, démangeaisons, sensation de brûlure cutanée, sécheresse cutanée, rougeurs, notamment en cas d’utilisation répétée.
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
Aucun cas de surdosage n’a été rapporté.
En cas d’ingestion accidentelle, ne pas faire de lavage gastrique (produit moussant).
Des mesures générales de soutient doivent être instituées comme cela est jugé nécessaire par le médecin.
Classe pharmaco thérapeutique : ANTISEPTIQUE ET DESINFECTANTS - Chlorhexidine en association, code ATC : D08AC52.
Solution à diluer pour application cutanée ou muqueuse, contenant de :
Antiseptique de faible activité, bactériostatique non bactéricide, trichomonacide, partiellement inhibée par les matières organiques.
Formation de complexes avec : liège, caoutchouc et autres polymères, macromolécules, tensioactifs anioniques (savons) et non-ioniques.
Aucune étude formelle de pharmacocinétique n’a été réalisée avec CYTEAL.
La pénétration des substances actives dans la peau est faible lorsque la posologie thérapeutique est respectée. Il est nécessaire de prendre en compte la localisation de l'application, la taille de la zone traitée, l'état de la peau (peau lésée ou non) et la durée du traitement (voir rubrique 4.4).
Les données non-cliniques disponibles ne révèlent aucun risque particulier pour l’homme dans le cadre des recommandations de l'administration, y compris le rinçage après utilisation sur la base des études conventionnelles de pharmacologie de sécurité, toxicité à doses répétées et la tolérance locale, génotoxicité, potentiel cancérogène, toxicité pour la reproduction et le développement.
L’irritation oculaire, l'irritation cutanée primaire et les études d'irritation vaginale ont démontré que le produit est irritant pour les yeux et non-irritant pour la peau et de la muqueuse vaginale.
Cocamidopropylbétaïne, diéthanolamide d’acide gras de coprah, acide édétique, parfum coniférol*, acide lactique, eau purifiée.
* composition du parfum coniférol : résinoïde de Galbanum, résinoïde d’Elemi, huile essentielle de Pimenta racemose, acétate d’isobornyle, décanal-2-méthylundécanal.
Le flacon ne doit pas être fermé avec un bouchon en liège.
2 ans.
A conserver à l'abri de la lumière et à une température inférieure à 25 °C.
Flacon en polyéthylène haute densité opacifié de 150 ml, 200 ml, 250 ml, 500 ml ou 1000 ml, fermé par un bouchon à vis en polyéthylène basse densité opacifié.
Toutes les présentations peuvent ne pas être commercialisées.
Pas d'exigences particulières.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
PIERRE FABRE MEDICAMENT
LES CAUQUILLOUS
81500 LAVAUR
Date de première autorisation : 11 octobre 1976
Date de dernier renouvellement : 05 août 2011
29 juillet 2024
Sans objet.
Sans objet.
CONDITIONS DE PRESCRIPTION ET DE DELIVRANCE
Médicament non soumis à prescription médicale.
Dernière mise à jour de cette page
17 septembre 2024.

Cyteal_Med_landing page_17.09.24_V1
![]() Adresse
Adresse
![]() Téléphone
Téléphone
Revue MAF
Revue OST
Actualités
Rubriques spécialités
Webinaires
Espaces labos