
Le guide de la médecine et de la santé
en Afrique francophone
Suivez-nous :
 Identifiez-vous | Inscription
Identifiez-vous | Inscription

Suivez-nous :
 Identifiez-vous | Inscription
Identifiez-vous | Inscription
 Au lendemain de la pandémie de COVID-19, les pays d'endémie palustre font face à des défis persistants. La fragilité des systèmes de santé, l'insuffisance de la surveillance et le manque chronique de fonds demeurent des obstacles majeurs.
Au lendemain de la pandémie de COVID-19, les pays d'endémie palustre font face à des défis persistants. La fragilité des systèmes de santé, l'insuffisance de la surveillance et le manque chronique de fonds demeurent des obstacles majeurs.
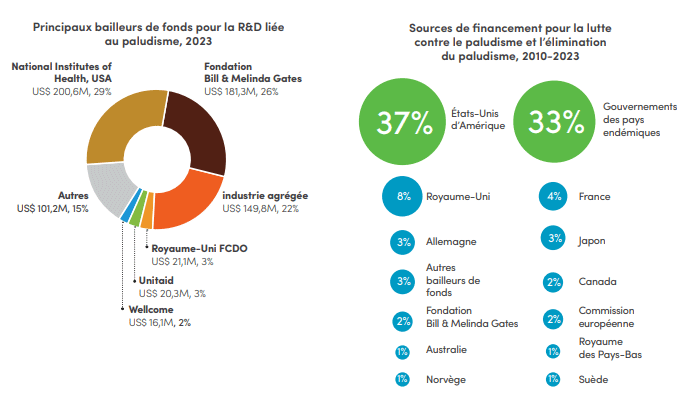
Au niveau mondial, les investissements dans la lutte contre le paludisme ont totalisé, selon les estimations, US$ 4 milliards en 2023, un chiffre bien en-deçà de l'objectif de US$ 8,3 milliards fixé dans la Stratégie mondiale de lutte contre le paludisme. Le déficit de financement s'est accentué ces cinq dernières années, passant de US$ 2,6 milliards en 2019 à US$ 4,3 milliards en 2023.
En Éthiopie, le nombre de cas de paludisme estimés a également plus que triplé, passant de 2,6 millions en 2019 à 9,5 millions en 2023. Ces dernières années, les services de santé de base et les mesures de prévention du paludisme ont été perturbés dans les zones de conflit et le pays a dû faire face à d'autres défis, y compris l'émergence du moustique Anopheles stephensi, la résistance aux insecticides et les effets du changement climatique.
Les températures en hausse et l'évolution des phénomènes météorologiques nuisent à la santé, à la sécurité et aux moyens de subsistance des populations dans le monde entier. Les premières victimes des effets les plus graves du changement climatique sont les communautés vulnérables en Afrique et plusieurs d'entre elles sont déjà plus exposées au risque de contracter le paludisme.
En 2023 par exemple, plus de 40 % des enfants de moins de cinq ans ainsi que des jeunes filles et femmes enceintes en Afrique subsaharienne n'ont pas dormi sous une moustiquaire imprégnée d'insecticide, qui est portant un outil essentiel de prévention du paludisme.
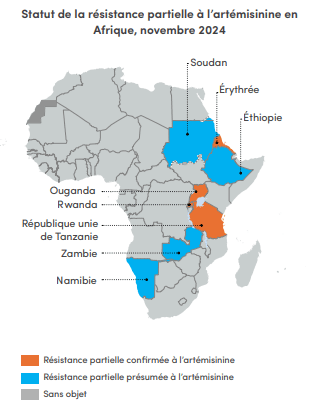 En Afrique, la propagation de la résistance aux médicaments antipaludiques est une vive source d'inquiétude
En Afrique, la propagation de la résistance aux médicaments antipaludiques est une vive source d'inquiétudeÀ ce jour, quatre pays d'Afrique de l'Est confirment la présence d'une résistance partielle à l'artémisinine (Érythrée, Ouganda, RépubliqueUnie de Tanzanie et Rwanda). En se basant sur les données disponibles, la même résistance est également suspectée dans quatre autres pays (Éthiopie, Namibie, Soudan et Zambie).
En 2022, l'OMS a lancé une stratégie visant à freiner la résistance aux antipaludiques en Afrique. Cette stratégie s'appuie sur les leçons tirées des plans d'action mondiaux du passé et complète les stratégies existantes, en y incluant des efforts plus intenses pour faire face à la résistance antimicrobienne.
Les quatre piliers de la « Stratégie de riposte face à la résistance aux antipaludiques en Afrique » :
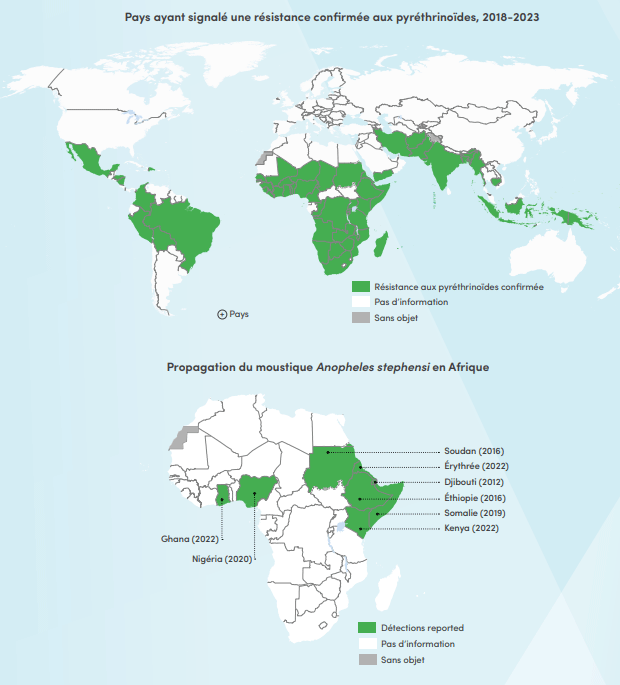 La résistance des moustiques aux pyréthrinoïdes reste très répandue
La résistance des moustiques aux pyréthrinoïdes reste très répandueLa résistance aux pyréthrinoïdes, le produit chimique le plus couramment utilisé sur les moustiquaires imprégnées d'insecticide, a été confirmée dans 55 des 64 pays où elle a été surveillée de 2018 à 2023. Les moustiquaires de nouvelle génération, qui offrent une meilleure protection contre le paludisme que les moustiquaires imprégnées uniquement de pyréthrinoïdes, sont de plus en plus souvent disponibles et constituent un outil important intégré aux efforts de lutte contre le paludisme à l'échelle mondiale. L'OMS a publié des recommandations concernant leur utilisation en 2017 et 2023, respectivement.
Originaires d'Asie du Sud et de la péninsule arabique, les espèces de moustiques invasives se sont répandues au cours de la dernière décennie et ont été détectées dans huit pays d'Afrique. An. stephensi peut se développer en milieux urbains, résiste à de fortes températures ainsi qu'à de nombreux insecticides utilisés dans le domaine de la santé publique. En 2022, l'OMS a lancé une initiative [en anglais uniquement] dans le but de sensibiliser ses États membres et partenaires à cette menace croissante et de catalyser les efforts déjà déployés pour stopper la propagation d'An. stephensi en Afrique.

Le rapport 2024 met en avant les tendances positives enregistrées concernant l'intensification des outils de prévention efficaces, notamment les moustiquaires de nouvelle génération, les vaccins contre le paludisme et la chimioprévention du paludisme saisonnier.
L'atteinte des objectifs fixés au niveau mondial contre le paludisme nécessitera une accélération des mesures d'urgence, surtout dans les pays d'Afrique les plus durement touchés. Les pays d'endémie palustre devraient être soutenus par un écosystème efficace de partenaires internationaux. Le cadre du « Big Push » a pour but de redynamiser la lutte contre le paludisme au niveau mondial en faisant davantage converger le soutien international vers les besoins spécifiques des pays affectés.
Pour la première fois cette année, le rapport sur le paludisme dans le monde comporte un chapitre exclusivement consacré au besoin d'une riposte plus efficace et plus inclusive, mettant l'accent sur l'action auprès des groupes les plus vulnérables face au paludisme et à ses conséquences. Accélérer les progrès en vue d'atteindre les objectifs fixés au niveau mondial exigera une plus grande concertation afin d'identifier et de franchir les obstacles à l'égalité des genres, aux droits humains et à l'équité en santé dans le cadre de la lutte contre le paludisme dans le monde.
Les informations présentées ci-dessus sont extraites de ce document que nous vous invitons à consulter dans son intégralité : Dossier d'information - Principaux messages - Rapport 2024 sur le paludisme dans le monde - 11 décembre 2024 - OMS

Pour la 1ère fois en Afrique et afin d'améliorer l'observance, la combinaison Artéméther-Luméfantrine est proposée sous forme de granulés effervescents.

Plus d'informations sur Combiart® 80/480 mg sachet de granulés effervescents
Recommandé en 1ère intention chez l'enfant et l'adulte en cas de paludisme non compliqué
Plus d'informations sur Combiart® 80/480 mg comprimés
Pour les poids corporels de 5 kg à > 35 kg
Plus d'informations sur Combiart® 20/120 mg comprimés
Artéméther 15 mg + Luméfantrine 90 mg dans chaque 5 ml de suspension. Pour les poids corporels de 5 kg à 15 kg
Plus d'informations sur Combiart® suspension

Plus d'informations sur Camvit Plus® gélules

Plus d'informations sur Strimol Extra®

Combiart® 80/480 mg, sachets.
Chaque sachet contient :
Granules effervescents.
Combiart® est indiqué pour le traitement du paludisme à Plasmodium falciparum aigu non compliqué chez les adultes.
Pour les patients de 12 ans et plus et de 35 kg de poids corporel et au-dessus, un cours de traitement comprend six doses d'un sachet chacun, c'est-à-dire un total de 6 sachets, donné sur une période de 60 heures comme suit : la première dose d'un sachet, donné au moment du diagnostic initial, devrait être suivie de cinq autres doses d'un sachet chacun donnés à 8, 24, 36, 48 et 60 heures par la suite.
Ce médicament ne doit pas être utilisé dans les cas suivants :
L'artéméther et la luméfantrine ne doivent pas être utilisés pendant le premier trimestre de la grossesse dans des situations où d'autres antipaludéens appropriés et efficaces sont disponibles. L'artéméther et la luméfantrine n'ont pas été évalués pour le traitement de paludisme sévère, y compris les cas de paludisme cérébral ou autres manifestations sévères comme l'œdème pulmonaire ou l'insuffisance rénale.
L'artéméther et la luméfantrine n'ont pas été étudiés chez les patients atteints d’insuffisance rénale ou d’ hépatique sévère et par conséquent aucune recommandation ne peut être faite pour ces groupes de patients.
L'artéméther et la luméfantrine ne sont pas indiqués pour le traitement du paludisme dû aux P. vivax, P. malariae ou P. ovale. Il n’ont pas été évalués pour ce traitement, même si certains malades dans les essais cliniques ont une co-infection avec le P. falciparum et P. vivax à la ligne de base.
L'artéméther et la luméfantrine sont actifs face aux étapes sanguines du Plasmodium vivax, mais ne sont pas actifs contre les hypnozoïtes. Par conséquent, un traitement séquentiel avec la primaquine peut être utilisé pour parvenir à l'éradication de l'hypnozoïte.
En raison de données limitées sur la sécurité et l'efficacité, l'artéméther et la luméfantrine ne devraient pas être administrés avec tout autre agent antipaludéen sauf s'il n'y a aucune autre option de traitement. Si l'état d'un malade se détériore pendant qu'il prend l'artéméther et la luméfantrine, le traitement alternatif pour le paludisme devrait commencer immédiatement. Dans ce cas, il est recommandé de contrôler l'électrocardiogramme (ECG) et des mesures devraient être prises pour corriger toutes les perturbations d'électrolyte.
La longue demi-vie d'élimination de luméfantrine doit être prise en compte en administrant la quinine chez les patients précédemment traité avec l'artéméther et la luméfantrine. Si la quinine est administrée après l'artéméther et la luméfantrine, un contrôle sérieux de l'ECG est conseillé. lorsque l'artéméther et la luméfantrine sont administrés après la méfloquine, il est conseillé de surveiller de près la consommation des aliments chez les malades qui ont été antérieurement traités avec l'halofantrine. L'artéméther et la luméfantrine ne devraient être administrés qu'un mois au moins après la dernière dose d'halofantrine. L'artéméther et la luméfantrine ne sont pas indiqués et n'ont pas été évalués pour la prophylaxie.
L'halofantrine, la quinine et la quinidine sont reconnues comme étant la cause de la prolongation de l'intervalle QT. La prolongation asymptomatique d'intervalles QTC par > 30 ms, avec QTC > 450 ms réel chez les hommes et > 470 ms chez les femmes, a été observée à 5% approximativement chez les patients traités avec des doses différentes d'artéméther et de luméfantrine dans des essais cliniques. Il est possible que ces changements soient liés à la maladie. Dans des essais cliniques chez les jeunes, la prolongation asymptomatique d'intervalles QTC > 30 msec a été observée chez 35% des enfants pesant 5-10 kg, 34.1% des enfants pesant 10-15 kg et 23% des enfants pesant 15-25 kg.
La prudence est recommandée lorsque l'artéméther et la luméfantrine sont combinés avec des médicaments exhibant des modèles variables d'inhibition, d’induction ou de compétition pour le CYP3A4.
Les malades qui refusent de s’alimenter pendant le traitement devraient être surveillés de près, le risque de recrudescence pouvant être plus grand.
Catégorie C.
L'efficacité des comprimés d'artéméther / luméfantrine dans le traitement du paludisme aigu non compliqué chez les femmes enceintes n'a pas été établie. Doit être utilisé pendant la grossesse que si l'avantage potentiel justifie le risque potentiel pour le fœtus.
L'avantage de l'allaitement pour la mère et l'enfant doit être pesé contre le risque potentiel pour le nourrisson exposé à l'artéméther et à la luméfantrine par le lait maternel.
La fréquence d'événements indésirables rapportés pendant l'essai clinique avec l'artéméther et la luméfantrine était similaire ou plus basse que celle d'autres médicaments antipaludiques.
L'artéméther et la luméfantrine étaient généralement bien tolérés par les enfants et les adultes, et la plupart des effets indésirables étaient de gravité et de durée bénignes ou modérées. Beaucoup d'effets rapportés vont probablement être rapprochés au paludisme sous-jacent et/ou à une réponse insatisfaisante au traitement plutôt qu'à l'artéméther et la luméfantrine. Pour d'autres rapports, d'autres facteurs alternatifs ont été identifiés comme la cause la plus probable des événements (par exemple, les médicaments concomitants, l'infection concomitante) ou les informations fournies étaient trop rares pour tirer une conclusion.
La relation informelle avec l'utilisation d'artéméther et de luméfantrine ne pouvait pas être exclue pour les effets indésirables suivants :
Les effets indésirables sont classés sous les titres de fréquence, de plus fréquent en premier, utilisant la convention suivante: Très commun (1/10); commun (1/100, < 1/10); non commun 1/1,000, < 1/100); rare (1/10,000, < 1/1,000); très rare (< 1/10,000), y compris les rapports isolés.
Très rarement : Hypersensitivité.
Commun : Palpitation.
Commun : Toux.
Commun : Prurits, éruption cutanée.
Commun : Arthralgie, myalgia.
Commun : Asthénie, fatigue.
La prolongation de QTc asymptomatique a été rapportée chez les adultes, les enfants et les nouveau-nés mais aucune relation causale avec l'artéméther et la luméfantrine ne pouvait être confirmée.
Vous pouvez signaler les effets secondaires en visitant le site https://www.strides.com/contact_DS.aspx ou en nous envoyant un courrier électronique à l'adresse drugsafety@strides.com. En signalant les effets secondaires, vous contribuez à fournir davantage d'informations sur la sécurité du médicament.
Cette combinaison fixe contient de l' Artéméther et de la Luméfantrine en proportion respective de 1 pour 6. Le site d'action antiparasite des deux composantes est la vacuole digestive du parasite où ils semblent altérer la conversion de l'hème, un intermédiaire toxique produit pendant la dissociation de l'hémoglobine, en hémozoïne non toxique, le pigment du plasmodium. La Luméfantrine est connue pour son interférence avec le processus de polymérisation, pendant que l'artéméther produit des métabolites réactifs suite à l'interaction entre son pont de péroxyde et l'hème ferrique. L'Artéméther et la Luméfantrine bloquent ensuite la synthèse de l'acide nucléique et de protéines intraparasitaires. L'activité antipaludique de la combinaison Artéméther et Luméfantrine est supérieure à celle de l'une ou l'autre des deux substances administrée seule.
La caractérisation pharmacocinétique de l'artéméther et de la luméfantrine est limitée par le manque d'une formulation intraveineuse et par la variabilité très élevée inter et intra sujet de l'artéméther et des concentrations de plasma de la luméfantrine et des paramètres pharmacocinétiques dérivés (AUC, Cmax).
L'artéméther est absorbé assez rapidement avec des concentrations de plasma maximales obtenues environ 2 heures après le dosage. L'absorption de la luméfantrine, un composé hautement lipophilique, commence après un temps de retard de près de 2 heures, avec une concentration de plasma maximale d'environ 6-8 heures après le dosage. L'alimentation augmente l'absorption aussi bien de l'artéméther que de la luméfantrine: chez les volontaires sains, la biodisponibilité relative de l'artéméther a été plus que doublée et celle de la luméfantrine a augmenté plus de seize fois lorsque l'artéméther et la luméfantrine ont été pris après un repas riche en matières grasses comparé au même produit pris dans des conditions de jeûne.
L'alimentation augmente l'absorption de la luméfantrine chez les malades atteints de paludisme, bien qu'à un degré moindre (approximativement le double), dû le plus probablement à la teneur en matières grasses inférieure des aliments ingérés par les personnes gravement malades. Les données d'interaction alimentaires indiquent que l'absorption de la luméfantrine dans des conditions de jeûne est très faible (en supposant 100% d'absorption après un repas riche en matières grasses que la même quantité absorbée dans des conditions de jeûne serait < 10% de la dose). Les malades devraient donc être encouragés à prendre les médicaments avec un régime normal aussitôt que les aliments peuvent être tolérés.
L'Artéméther et la luméfantrine sont tous les deux fortement liés aux protéines du sérum humain dans les essais in vitro (95.4% et 99.7%, respectivement). Le dihydroartémisinine est aussi lié aux protéines du sérum humain (47-76%). La protéine liée au plasma humain est linéaire
L'Artéméther est rapidement et largement métabolisé (métabolisme substantiel de premier passage hépatique) dans les essais in vitro et chez l'homme. Les microsomes du foie métabolisent l'artéméther au métabolite principal biologiquement actif, le dihydroartémisinine (deméthylation), principalement à travers l'isoenzyme CYP3A4/5. Ce métabolite a aussi été détecté chez l'homme dans les essais in vivo. Le ratio de l'ASC de l'artéméther/ dihydroartémisinine est 1,2 après une dose unique et 0,3 après 6 doses administrées pendant 3 jours. Les données in vivo indiquent que les artémisinines ont une certaine capacité pour inciter les isoenzymes du cytochrome CYP2C19 et CYP3A4. Le dihydroartémisinine est de nouveau converti en métabolites inactifs. La luméfantrine est N- débutylée, principalement par CYP3A4, dans les microsomes du foie humain. Dans les essais in vivo chez les animaux (chiens et rats), la glucuronidation de la luméfantrine a lieu directement et après biotransformation oxydative. Chez l'homme, l'exposition systémique au métabolite desbutyl- luméfantrine, pour lequel l'effet antiparasitaire in vitro est 5 à 8 fois plus élevé que la luméfantrine, était moins de 1% de l'exposition à la drogue mère. Les données sur la débutyle-luméfantrine ne sont pas disponibles dans le cas spécifique d' une population africaine. Dans les essais in vitro, la luméfantrine inhibe significativement l'activité du CYP2D6 aux concentrations thérapeutiques du plasma.
L'artéméther et le dihydroartémisinine sont rapidement éliminés du plasma avec une demi-vie d'élimination d'environ 2 heures. La Luméfantrine est éliminée très lentement avec une demi-vie terminale de 2 à 3 jours chez les volontaires sains et de 4-6 jours chez les malades atteints de paludisme falciparum. Les caractéristiques démographiques comme le sexe et le poids semblent n'avoir pas d' effets cliniquement appropriés sur la pharmacocinétique de l'artéméther et de la luméfantrine. Aucune donnée sur l'excrétion urinaire n'est disponible pour l'homme. Chez les rats et les chiens l'artéméther inchangé n'a pas été détecté dans les excréments et dans l'urine en raison de son métabolisme rapide et de premier passage élevé, mais plusieurs métabolites (non identifiés) ont été détectés tant dans les excréments que dans l'urine. La luméfantrine est éliminée via la bile chez les rats et les chiens, avec une excrétion principalement dans les excréments. Après le dosage oral chez les rats et les chiens, la récupération qualitative et quantitative de métabolites dans la bile et dans les excréments était relativement faible, la plus grande partie de la dose étant récupérée en tant que produit actif.
Aucun essai pharmacocinétique spécifique n'a été effectué chez les malades atteints d'insuffisance hépatique ou rénale ou chez les enfants ou les patients âgés.
Sans objet.
Non renseigné.
Sans objet.
24 mois.
A conserver à une température ne dépassant pas 30 °C.
A conserver dans l'emballage d'origine à l'abri de la lumière et de l'humidité.
Tenir hors de portée des enfants.
Boîte de 6 sachets.
Pas d'exigences particulières.
Strides Pharma Science Limited
Strides House, Opp IIM,
Bilekahalli, Bannerghatta Road,
Bangalore-560 076, INDIA.
Mars 2019.
Dernière mise à jour de cette page : 01/02/2024.
Liste I
![]() Adresse
Adresse
![]() Téléphone
Téléphone
Revue MAF
Revue OST
Actualités
Rubriques spécialités
Webinaires
Espaces labos